4.医薬品開発におけるGMP製造
~理工学類、文系のベンチャー立ち上げの可能性~
医薬品開発の作業には表1記載のものがあります。薬学、医学だけでなく、毒性学、微生物学、工学、理学、心理学、法学などの広い分野の人が関わる産業なの です。 概ね表1の順に開発が進みますが、開発が成功し、GMP(Good Manufacturing Practice)と呼ばれる製造段階からは格段に費用も時間も 必要になります。この段階から後の作業に関しては、理工、文系の別なく、誰でも、ベンチャーを立ち上げる機会は多いと考えられます。なお、GMP製造は、日本語では 「医薬品及び医薬部外品の製造管理及び品質管理の基準」の事で、法律です。
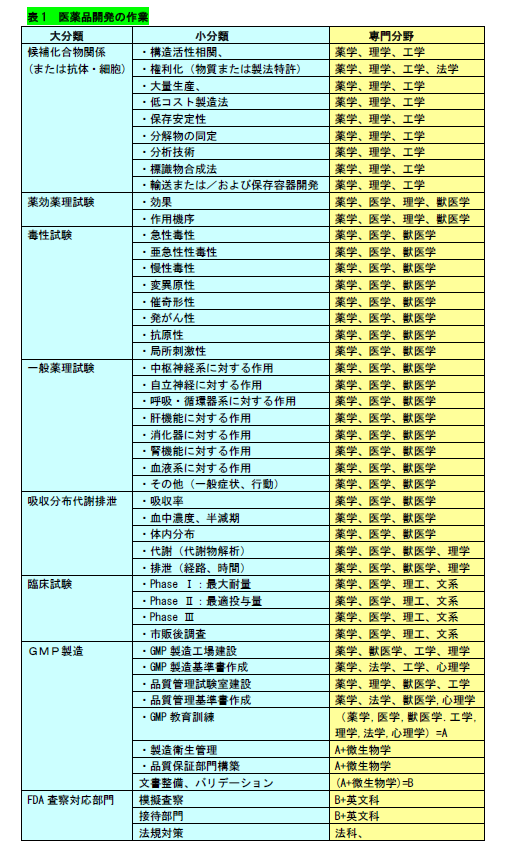
開発が進めば、色々な部門の協力が必要になってきます。ここでは、GMPを臨床試験の後に記載しましたが、実際にはその初期の段階からGMP製造された医薬品が 必要になります。バリデーション(validation)は「確認,承認」の意味で、GMP製造では必須の作業です。FDA査察では、行った事の正しさを文書で証明する必要が あり、その為の作業です。上の表では分けて記載してありますが、このバリデーションは総ての段階で必要です。査察の前には、文書による証拠が揃っている事を
表1では薬学者、医学者が中心の如く書かれていますが、実際の作業を行っている人は多岐に亘ります。医師は臨床が忙しく、研究・開発に時間が割けませんし、 薬剤師も半ば同様です。医薬開発は色々な人に支えられて進行しているのです。
それらの人達にとっては異分野の仕事と言えますが、立派にこなしています。
1 GMP製造のコスト
平成26年2月3日(月)、日経バイオテクONLINEメールに記載された例を紹介しましょう。
<臨床試験の例>
札幌医科大学の本望教授らが自己骨髄細胞を培養した間葉系幹細胞STR01によって脳梗塞患者の医師主導臨床試験を展開している。
患者さんの腸骨から採取した骨髄細胞を2週間培養、最終的にはシャーレ120枚分に増殖、それを集めて細胞1億個を点滴静注1時間で患者さんの体内に移植する。 もう一つの特徴は患者さんの自己血清を使い、この細胞(STR01)を培養する。静脈注射したSTR01は動物実験では脳梗塞巣に移動し、組織の再生を促進する。また、事前 の臨床研究でも、その効果は確かめられている。そのため、今回フェーズIII臨床試験から治験を着手することができた。
<GMP製造のコストと必要性>
最大の問題はGMP製造にある。臨床試験でPOC(proof of concept)「有効性の実証」が取れたとしても、コストが膨大では幅広く 患者に恩恵を返すことができない。「GMP製造はランニングするのも大変、施設を造り上げ査察をクリアするのも大変。すべてが大変」(本望教授)。最大の問題である。
コストは、実験室レベルは10万円でできるが、GMP製造すると少なくとも300万円(製造100万円、検査100万円、環境モニタリングとドキュメント100万円)は必要だ。 これに+人件費+GMPの維持+原価償却などを加えれば、1000万円以上はかかってしまう。
商業化するためには、GMP製造で厳密に製造しないと、同じ名前の例えば、間葉系幹細胞では性質が異なることは容易に起こりうるので、やはり再生医療にはGMP製造 がどうしても不可欠である。これは学問研究にも当てはまる可能性があり、再生医療で物を言うためにも、GMP製造のような細胞の製造手法と製造物の品質管理が避けられ ないということになります。
引用した前記日経バイオの記事のように、GMP製造にはお金が掛かります。しかし、信頼性を保証するためには必須なのです。若し、GMP製造を安価かつ確実に行う 方法を確立すれば、ベンチャーとして十分やっていけるはずです。
現在は主として日揮、千代田化工建設等いわゆるゼネコンがGMP工場などハードの建設とそれが正しく作動する事を証明する「バリデーション」と呼ばれる作業を 請け負っています。FDA査察の経験者を抱え、当局の査察に対応できる、いわゆるノウハウを持って営業しています。
高額な金品が動く世界です。少し修行を積まなければなりませんが、この分野を攻めてゆけば、ベンチャー創設のチャンスは多いと考えられます。事実、1匹 オオカミでFDA査察支援を業とする人にも出会いました。範囲は教育訓練分野だけでしたが、十分成り立っていました。
再生医療は今後の医療研究の花形です。平成26年2月10日付日経バイオによると、下村・文科大臣も再生医療実現を支援する事が明確です。
再生医療実用化の可能性が高まった今、GMP製造やそのためのバリデーションは大きなビジネスチャンスと考えられるのです。
2 GMP製造で求められるもの
GMP製造で求められるものは、同じ品質の薬または再生医療にあっては「細胞」を再現性良く造る事および汚染の無い製品を造る事です。抗生物質や化学合成で 造られる比較的低分子の医薬品なら、それらの確立は比較的容易ですが、「細胞」となるとどちらも困難が伴います。分化の程度や、組成など、細胞の質を毎回同じに 調える必要がある上、人体に投与しますので、無菌性を担保しなければなりません。従来品はオートクレーブなどで加熱滅菌するか、熱に弱い製品なら、ろ過滅菌という 手法で無菌にしていましたが、細胞ではどちらも使えません。因みに、細胞は、細菌やウイルスより大きいのです。また、注射で投与する薬は、発熱性物質として知られ ていた多臓器不全の原因になるリポポリサッカライド(LPS)も混入してはなりません。LPSはグラム陰性細菌の膜成分で、不潔に製造すれば、簡単に医薬品を汚染する 物質なのです。注射または移植用細胞は最初から菌やウイルス、LPSなど汚染物質が混入しないような製法を確立しなければならないのです。
細胞分化の段階を揃え、しかも培養に当たっては、最初から最後まで汚染が無いよう管理し、尚且つそれを証明しなければならないのです。
薬品(または細胞)の質は、毎回同じでなければなりません。良くなったからこちらにしようと言うのもいけません。同じでなければ、それまで調べてきたデータが 無駄になってしまうからです。良すぎて何が悪いと考えがちですが、そうではないのです。
引用した日経バイオの例では、GMP製造のコストは、試験室では10万円で出来るのに対し1000万円となっていましたが、それはむしろ控えめな見積もりで、ハード (工場)の製造、無菌環境、無菌の水、分析設備、分析方法の確立、規格の設定、GMP製造基準書、衛生管理基準書、教育訓練、各種バリデーション等々必要な事柄を 考えますと、億単位の費用が必要になってくるはずです。たった1%でも効率的な方法を実用化すれば数100万円のメリットが出てきます。ビジネスチャンスです。
3 GMP製造では何を証明しなければならないか?
大きく分けて3つです。
1、 製造した工場(製造場所)および装置の適格性
2、 実際に製造したものの同一性
3、 毎製造時の適格性
いずれもバリデーションを行い、文書として記録を残します。
1、では設計の適格性(DQと言います)、据え付けの適格性(IQと言います)、運転の適格性(OQと言います)、実際に製品が製造できる事の適格性(PQと 言います)を調べます。
バリデーションは工場の建物だけでなく、そこに設置される装置にも必要です。空気を無菌にする装置なら装置自身と無菌の空気を、注射用水製造装置なら、その 装置自身と水の品質を調べます。各ユースポイント(蛇口)について水質を調べる事が要求されます。
反応(培養)タンク、インキュベータ―、遠心機、無菌室、クリーンベンチ、器具類の滅菌器にも性能検査は必要です。クリーンベンチや滅菌器など重要工程の機器 類は6か月に1度の定期検査が必要です。
2、では、米国の基準では、3バッチの製品を造り、その品質が同等であることを証明します。1バッチでも基準を外れれば、製法は確立していないと評価され、 やり直しです。
3、では製造毎にモニタリングし、外れた製品が出来ていないことを証明します。外れた場合は厳しく原因を究明し、その記録と改善手法、日付、責任者(実施者) のサインを残します。記録にはボールペンを用い、修正する場合は見え消しにし、修正理由と日付、修正した者のサインを記録します。若し、コンピュター入力なら 信頼性を保証するため、米国ならば、CFR Part11に準拠しなければなりません。
製品だけでなく、その時のクリーンルーム、無塵衣(無菌)を着た作業者の汚染の有無など、製造環境もモニタリングしなければなりません。品質は製造工程で造り 込まれるものだからです。
このような品質の良い医薬品を造り上げる研究はregulatory science と呼ばれ、学問になっています。その学会として有名なものに米国のPDA (Parenteral Drug Association)学会があります。日本にも支所があります。
4 世界標準との繋がり
バリーデーションでは、的確であることを種々の計器を用いて証明しますが、そのいずれの計器も、世界標準と繋がっていなければなりません。世界標準には メートル原器など知られていますが、それらをいちいち日本に持って来るわけでは無く、それらで定期的に校正した計器またはそれらマザーマシーンで校正した子機、 孫機を用い、使用しようとする計器を校正しなければなりません。温度計、湿度計、風速計、レーザーパーティクルカウンター、K型熱電対等、白金温度センサーなど 多岐に亘ります。
無菌室の検査では微粒子数、気流、差圧、無菌性を調べますが、そこでは細菌検査も当然行います。その際に用いる培地は、菌の増殖力のない培地ではいけませんの で、培地の能力も毎回√n +1の頻度で抜き取り検査します。その際に用いる標準菌は米国ATCC(American type culture collection)登録の標準菌と繋がっていなければ なりません。日本では理研、大阪発酵研究所から購入する事ができます。
LPSの検査も米国標準品と繋がっていないといけません。
バリデーションを請け負う会社は、これら校正済みの計器を保持し、前述のゼネコンから検査を請け負っています。
このように、GMP製造では設備・機器の適格性を定期的に調べる必要があり、これも立派な業となっています。
次回はバリデーションの実際について述べます。ベンチャー創設の可能性を見つけて下さい。
文責&連絡先:国立大学法人 金沢大学 先端科学・イノベーション推進機構
客員教授 長江 英夫 博士(工学)、獣医師
nagaehi@staff.kanazawa-u.ac.jp 携帯:090-7670-5508






